SMA: opublikowano raport z oceny efektywności terapii genowej
AOTMiT przeanalizował dane dot. 35 pacjentów z rdzeniowych zanikiem mięśni (SMA) leczonych w Polsce terapią genową, refundowaną od 1 września 2022 r.
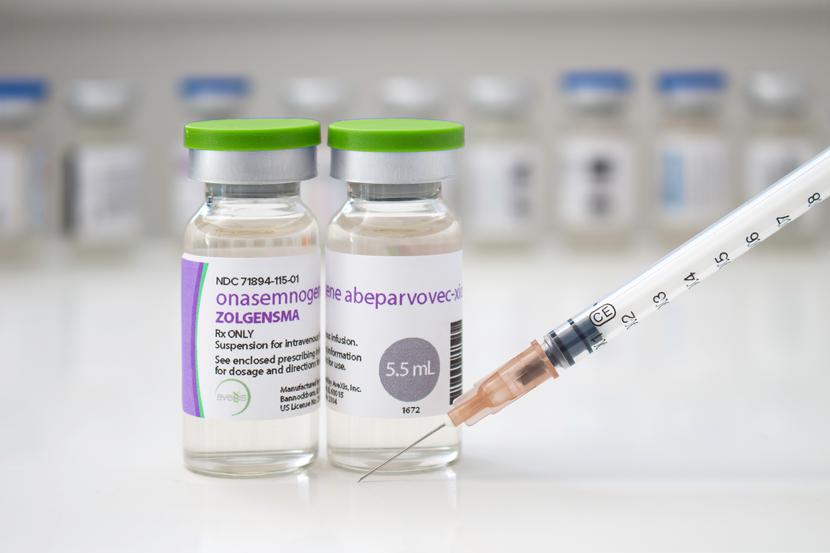
3 czerwca ukazał się raport Agencji Oceny Technologii Medycznych i Taryfikacji (AOTMiT) z oceny efektywności oraz jakości leczenia rdzeniowego zaniku mięśni terapią genową Zolgensma (onasemnogen abeparwowek).
Zolgensma została oceniona przez Agencję w ramach tworzenia wykazu technologii lekowych o wysokim poziomie innowacyjności (TLI), opublikowanego 26 lutego 2021 r., i objęta refundacją ze środków Funduszu Medycznego 1 września 2022 r. w ramach programu lekowego B.102.FM. Leczenie chorych na rdzeniowy zanik mięśni (ICD-10: G12.0, G12.1). 3 czerwca 2024 r. minęło zatem 90 dni do wygaśnięcia decyzji refundacyjnej, a zgodnie z Ustawą o świadczeniach opieki zdrowotnej finansowanych ze środków publicznych, na 90 dni przed zakończeniem okresu refundacji technologii lekowej o wysokim poziomie innowacyjności Agencja publikuje raport z oceny efektywności objętych refundacją TLI oraz jakości leczenia w oparciu o dane z rejestrów medycznych lub elektronicznego systemu monitorowania programów lekowych, pod warunkiem że dane kliniczne niezbędne do opracowania tego raportu są wystarczające.
ZOBACZ TAKŻE: Zolgensma - najdroższy lek na świecie stosowany w SMA refundowany od 1 września 2022
Przeanalizowane dane 35 pacjentów z SMA leczonych terapią genową
AOTMiT podkreśla w raporcie, że przeanalizowane dane są niedojrzałe – analiza obejmowała pacjentów włączanych do programu lekowego w okresie niespełna 1,5 roku. “Ogólne wnioski wskazują, że pacjenci leczeni w ramach programu lekowego uzyskali wyniki nie gorsze niż uczestnicy głównego badania rejestracyjnego ocenianej technologii. Nie odnotowano żadnego zgonu ani konieczności stałej wentylacji mechanicznej, u większości pacjentów odnotowano zadowalające wyniki rozwoju motorycznego, a profil bezpieczeństwa jest zbieżny z wynikami badania klinicznego” - czytamy.
Analizie poddano dane dotyczące 35 pacjentów leczonych w ramach programu lekowego B.102.FM. włączonych w okresie od 19 września 2022 r. do 26 lutego 2024 r.
66% pacjentów stanowiły niemowlęta płci żeńskiej. U większości pacjentów potwierdzono rozpoznanie ICD-10: G12.1 (n=26; 74%), typ przedobjawowy (n=30; 86%) oraz z trzema kopiami genu SMN2 (n=21; 60%).
Kwalifikacja do programu lekowego oznaczona została jako punkt kontrolny 0. Monitorowanie leczenia obywało się na podstawie kolejnych punktów kontrolnych (dla poszczególnych punktów końcowych w czasie raportowania zgodnym z opisem programu lekowego) – dane w momencie odcięcia w dniu 19.04.2024 r. obejmują 5 takich punktów. Pierwszy włączony do programu lekowego pacjent otrzymał lek 03.10.2022 r., a ostatni punkt kontrolny dla tego pacjenta zaraportowano w dniu 23.01.2024 r. (ok. 16 miesięcy obserwacji). Najkrótszy okres obserwacji pojedynczego pacjenta wyniósł ok. 3 miesięcy.
Jak wskazuje AOTMiT w raporcie, dane, na podstawie których przeprowadzono analizę, są niedojrzałe – wyniki z ostatniego, piątego punktu kontrolnego były dostępne jedynie dla 8 pacjentów.
Przeanalizowano dane dotyczące wskaźników oceny skuteczności leczenia wg opisu programu lekowego B.102.FM. i zgodnie z dostępnymi danymi SMPT: wyniki w skali CHOP-INTEND, konieczność stałej wentylacji mechanicznej oraz wyniki osiągania kamieni milowych rozwoju motorycznego.
Raport zawiera osobne dane nt. skuteczności leczenia nusinersenem
Z uwagi na zapisy ustawowe (ustawa refundacyjna) w raporcie AOTMiT przedstawiono również wyniki efektywności opcji alternatywnych, stosując założenia umożliwiające dobór populacji jak najbardziej zbliżonej do pacjentów kwalifikujących się do leczenia produktem leczniczym Zolgensma i w zakresie zbieżnych wskaźników efektywności. Analizy dokonano na podstawie danych z Systemu Monitorowania Programów Terapeutycznych (SMPT) dla substancji czynnej nusinersen. Substancja czynna rysdyplam została wykluczona z analizy, ponieważ była stosowana u pacjentów z innym typem SMA, niewpisującym się we wskazanie refundacyjne Zolgensma.
“Ze względu na fakt, iż niemożliwe jest wiarygodne porównanie skuteczności i bezpieczeństwa opcji leczenia bez zastosowania randomizacji, w różnych populacjach, opisane wyniki nie stanowią porównania ocenianego produktu leczniczego z opcją alternatywną, a jedynie przedstawiają osobno dane na temat skuteczności i bezpieczeństwa obu interwencji oraz ogólne wnioski na temat różnic wyników w zakresie zbieżnych punktów końcowych” - zaznaczono.
Dodatkowo w opracowaniu dokonano przeglądu dostępnych dowodów naukowych w celu aktualizacji informacji opisanych w ramach raportu sporządzonego w trakcie tworzenia wykazu TLI, na podstawie którego terapia genowa została umieszczona na liście TLI, a następnie na tej podstawie objęta refundacją ze środków Funduszu Medycznego.
ZOBACZ TAKŻE: Terapia genowa w SMA: od 1 kwietnia ważna zmiana w programie lekowym
Źródło: Puls Medycyny


![W Europie zanieczyszczenia powietrza powodują 800 tys. zgonów rocznie [WIDEO]](https://images.pb.pl/filtered/84b29d13-0727-4f42-8b21-de9566273376/76b0a951-3dc2-5503-975c-34480424e917_xc_l.jpg)
![Szansa na poprawę jakości życia dla pacjentów z HS [WIDEO]](https://images.pb.pl/filtered/08d54b79-36f0-499d-9e5e-731b6fdc1725/5e01a470-0cd4-51a2-9c4e-afeee2fc55b0_xc_l.png)