GIF wycofał lek hamujący krwawienia. Możliwa obecność szkła w leku
Główny Inspektor Farmaceutyczny wycofał z obrotu na terenie całego kraju serię produktu leczniczego Tranexamic acid injection BP. Powodem tej decyzji jest wada jakościowa.
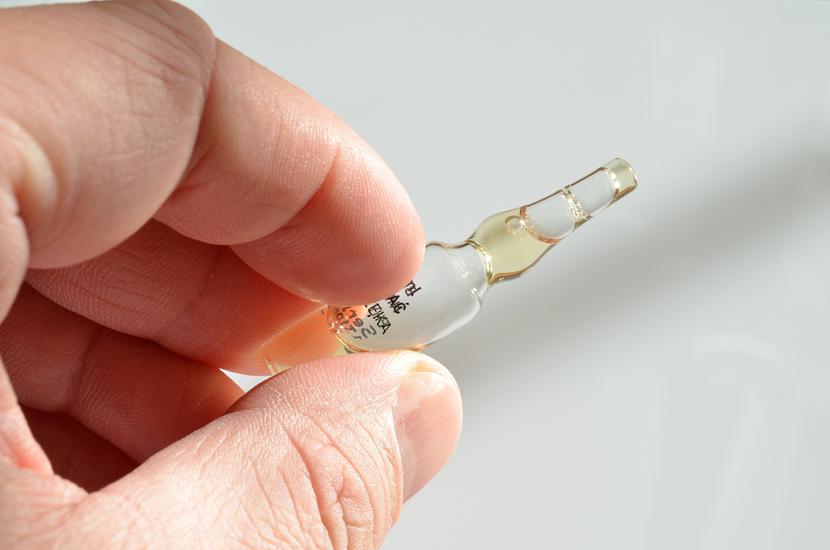
GIF wycofał z obrotu na terenie całego kraju produkt leczniczy:
- Tranexamic acid injection BP, (Acidum tranexamicum), 500 mg/5 ml, roztwór do wstrzykiwań, opakowanie 10 ampułek, seria numer: I-11186 termin ważności 31.05.2026 r., podmiot odpowiedzialny: Jackson Loboratories Pvt. Ltd, Indie.
Podmiot, który uzyskał zgodę Ministra Zdrowia na czasowe dopuszczenie do obrotu produktu leczniczego: Urtica sp. z o.o. Decyzja ma rygor natychmiastowej wykonalności.
PRZECZYTAJ TAKŻE: Lek przeciwbólowy z morfiną wycofany z obrotu
Kruszące się ampułki leku
Do GIF wpłynęło zgłoszenie z Wojewódzkiego Inspektoratu Farmaceutycznego w Olsztynie i w Poznaniu oraz z Hurtowni Farmaceutycznej w Łodzi prowadzonej przez spółkę Urtica o wystąpieniu wady jakościowej wymienionej serii leku Tranexamic acid injection BP.
Wada ta polega na braku możliwości standardowego otwarcia leku, kruszeniu się ampułki, a w związku z tym, brakiem pewności czy resztki szkła nie dostały się do jej wnętrza i nie zanieczyściły produktu leczniczego.
PRZECZYTAJ TAKŻE: Lek na nadciśnienie płucne wycofany z obrotu z powodu zanieczyszczeń
Tranexamic acid hamuje krwawienia
Lek Tranexamic acid zawiera kwas traneksamowy, który należy do grupy leków nazywanych lekami przeciwkrwotocznymi, lekami przeciwfibrynolitycznymi. Stosowany jest w podaniu dożylnym, w celu zapobiegania i leczenia krwawień wywołanych przez proces, który hamuje krzepnięcie krwi, nazywany fibrynolizą.
Na podstawie zgromadzonych danych, biorąc pod uwagę drogę podania leku, stwierdzono możliwość wystąpienia zagrożenie zdrowia i życia dla pacjenta w związku z brakiem możliwości użycia leku w trakcie wystąpienia krwawienia oraz ryzyka podania pacjentowi leku zawierającego szkło. W związku z tą sytuacją GIF zdecydował o wycofaniu z obrotu na terenie całego kraju wymienionej serii leku.
Źródło: Puls Farmacji





![W Europie zanieczyszczenia powietrza powodują 800 tys. zgonów rocznie [WIDEO]](https://images.pb.pl/filtered/84b29d13-0727-4f42-8b21-de9566273376/76b0a951-3dc2-5503-975c-34480424e917_xc_l.jpg)
![Szansa na poprawę jakości życia dla pacjentów z HS [WIDEO]](https://images.pb.pl/filtered/08d54b79-36f0-499d-9e5e-731b6fdc1725/5e01a470-0cd4-51a2-9c4e-afeee2fc55b0_xc_l.png)




![Popularne leki na odchudzanie i cukrzycę zmniejszają ryzyko wystąpienia niektórych nowotworów [BADANIE]](https://images.pb.pl/filtered/501a8320-66e2-45e0-b35d-144626ecb33e/581b30c6-b3c5-5ee9-9277-5115222b2423_mc_4.jpg)
![Przyjmowanie preparatów multiwitaminowych nie przedłuża życia, a wręcz może je skracać [BADANIA]](https://images.pb.pl/filtered/01a0544d-fda5-48f0-8c10-ee7e476368ab/cfb1d837-7a5e-5705-aa54-f5878b543446_mc_4.jpg)
